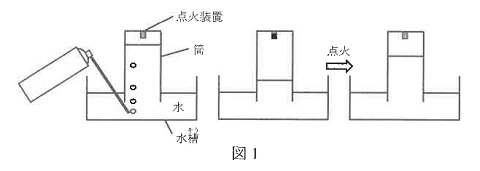
2024年女子学院の問題です。
1 次の気体A~Eに関する以下の問いに答えよ。
A 酸素 B 塩化水素 C 水素 D アンモニア E 二酸化炭素
(1)次の①~③にあてはまる気体を、A~Eから選びなさい。
① 空気中でどんな物質を燃やしたときでも、燃やした前後で量が変わる気体
② においがある気体
③ 水溶液を赤色リトマス紙につけると青色に変える気体
(2)A~Eの気体がそれぞれ入っているびんがある。二酸化炭素がどれに入っているかを調べる方法とその結果を合わせて答えなさい。
(3)二酸化炭素は水よりも水酸化ナトリウム水溶液に多く溶ける。このことと原因が最も似ている現象を次のア~エから選びなさい。
ア ミョウバンは、水温を上げた方が水に多く溶ける。
イ 室温では、同量の水にミョウバンより食塩の方が多く溶ける。
ウ 鉄は、水には溶けないが塩酸には溶ける。
エ ニ酸化炭素は、水温を下げた方が水に多く溶ける。
2
うすい塩酸5㎝3に液Aを1滴加えた後、ピペットを使ってうすいアンモニア水を0.5cm3ずつ加え、液の色が青色に変わったときのアンモニア水の体積を調べた。
(1)液Aは何か、次のア~エから選びなさい。
ア 紫キャベツ液 イ BTB液 ウ ヨウ素液 エ 水酸化ナトリウム水溶液
(2)ピペットの使い方として正しいものを次のア~エから選びなさい。
ア ピペットを使うときにはゴム球の部分だけを持つ。
イ ピペットの先をとりたい液に入れてゴム球を押して、ゴム球への力をゆるめ、液をゆっくり吸い上げる。
ウ 必要な量をはかりとれたら、ゴム球への力を少しゆるめて別の容器まで移動し、ゴム球を押して液を容器に注ぐ。
エ ピペットを使い終わったら、ゴム球を下にして立てて置くか、バットなどに横向きに置く。
(3)様々な体積のうすい塩酸を用意して上と同じ実験を行った。うすい塩酸の体積を横軸、色が変わったときのアンモニア水の体積を縦軸にしたときのグラフを次のア~エから選びなさい。
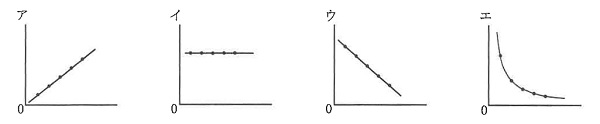
(4)うすい塩酸の体積は変えずに、様々な濃さのアンモニア水を用意して上と同じ実験を行った。アンモニア水の濃さを横軸、色が変わったときのアンモニア水の体積を縦軸にしたときのグラフを(3)のア~エから選びなさい。
(5)うすい塩酸にうすいアンモニア水を加えた液を蒸発皿にとって加熱すると、白色の固体が残る。
そこで、うすい塩酸30 cm3 を入れたA~Eの5つのビーカーに、異なる体積のうすいアンモニア水を加え、この液を加熱した。
加えたアンモニア水の体積と加熱後に残った固体の重さは下の表のようになった。
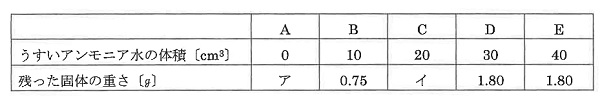
①表のア、イにあてはまる固体の重さは何gですか。
②うすい塩酸10cm3 で白色の固体を最大量つくるには、うすいアンモニア水を少なくとも何cm3加えたらよいですか。
【解説と解答】
1
(1)
①空気中でものを燃やせば、酸素は必ず減ります。
②匂いがあるのは塩化水素とアンモニア。
③アルカリ性はアンモニア。
(答え)
① A ② B,D ③ D
(2)二酸化炭素は石灰水に反応して白くにごります。
(答え)石灰水を入れてよくふると,白くにごる。
(3)酸性やアルカリ性のものによく溶ける性質になるので、ウ。
(答え)ウ
2
(1)青色に変わったのでBTB溶液。
(答え)イ
(2)ゴム球は押したまま、とりたい液にいれます。はかりとれたら、ゴム球をゆるめて別の容器まで移動し、そのあと、ゴム球を押して液を容器に注ぎます。
(答え)ウ
(3)塩酸の体積が多ければ、アンモニア水も多く必要で、比例関係です。
(答え)ア
(4)アンモニアの濃さと中和に必要なアンモニアの体積は反比例します。
(答え)エ
(5)
①アはアンモニアがないので、固体は残りません。10cm3あたり、0.75g増えて、1.80gになるのは、1,80÷0,75=2.4から10×2.4=24cm3のときに中和します。
したがって20cm3は0,75×2=1.50
②実験の3分の1の量ですから24÷3=8
(答え)① ア 0 イ1.50 ② 8
受験で子どもと普通に幸せになる方法、本日の記事
偏差値と問題の難易度
【(株)邦学館からのお知らせ 】
WEBワークスを塾・個別指導でご利用いただける「フリーダムスポット」のご案内