2024年開成中学の問題です。
Ⅰ 5種類の水溶液A~Eを試験管に用意して実験1~実験3を行いました。これらの水
溶液は、以下の6つのいずれかであることがわかっています。
アンモニア水 ・ 塩酸 ・ 重そう水 ・ 食塩水 ・ 石灰水 ・ 炭酸水
実験1 水溶液を蒸発皿に入れ、加熱して水を蒸発させると、水溶液B、C、Dでは白い固体が残りましたが、水溶液A、Eでは何も残りませんでした。
実験2 においをかぐと、においがあったのはAだけでした。
実験3 水溶液A、Eは青色リトマス紙を赤色に、水溶液B、Cは赤色リトマス紙を青色に変えましたが、水溶液Dでは、リトマス紙の色の変化はありませんでした。
問1 水溶液Eの名前を答えなさい。
問2 水溶液Aの名前を答えなさい。
問3 水溶液A~Eをすべて特定するためには、少なくともあと1つの実験をする必要があります。その実験として最も適切なものを、次のア~エの中から1つ選び、記号で答えなさい。
ア BTB溶液を水溶液に加えてみる。
イ 二酸化炭素を水溶液にふきこんでみる。
ウ 実験1で得られた白い固体に磁石を近づけてみる。
エ 実験1で得られた白い固体が電気を通すか調べてみる。
Ⅱ 水溶液の酸性・中性・アルカリ性を知る方法はリトマス紙やBTB溶液以外にも複数あり、例えば、ムラサキキャベツにふくまれるアントシアニンという、多様な色を示す色素を利用する方法もあります。さらに複数の色素をしみこませた万能試験紙(図1)を使うことで、酸性やアルカリ性の「強さ」を調べることができます。強さはpHで表し、中性を7とし、多くの水溶液は0から14までの数値で表されます。数値が7から小さくなるほど強い酸性、大きくなるほど強いアルカリ性であることを示しています。
ここでは医薬品にも使われるほう酸と、果実などに入っているクエン酸に注目し、万能試験紙を使って、実験4~実験7を行いました。
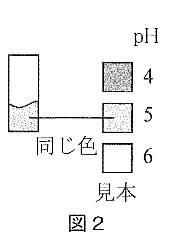
実験4 ほう酸を25℃の水80gにとかしたところ、4.0gまでとけました。ガラス棒の先を使って、この水溶液を万能試験紙につけたところ、万能試験紙の色が変わりました。色が変わった万能試験紙と見本を図2のように比べたところ、pHは5程度であることがわかりました。この水溶液を50℃まで温めたところ、ほう酸はさらに4.8gとけました。
実験5 クエン酸についても実験4と同様に、25℃の水80gにとかしたところ、60gまでとけました。水溶液のpHは、クエン酸を水80gに4.0gとかした時点で2程度になり、最終的に60gをとかしたとき、pHは1程度になりました。
実験6 実験4で得られたpHが5程度のほう酸水溶液にスチールウールを入れたところ、あわは発生しませんでした。一方、実験5で得られたpHが1程度のクエン酸水溶液では、あわが発生しました。
実験7 ほかの酸の水溶液についても酸性の強さを調べました。市販の酢では、pHは2~3程度でした。実験室にあった濃度3%の塩酸では、pHは0~1程度でした。
問4 実験4の結果より、ほう酸は50℃の水100gに何gとけることがわかりますか。ただし、答えが整数にならない場合は、小数第1位を四捨五入して整数で答えなさい。
問5 50℃の水100gにほう酸を7.0gとかしました。この水溶液を25℃まで冷やしたとき、水を何g追加すれば、25℃でほう酸をとかしきることができますか。25℃の水にほう酸がとける限界の量は実験4の結果から判断して答えなさい。ただし、答えが整数にならない場合は、小数第1位を四捨五入して整数で答えなさい。
問6 実験4~実験7の結果から言えることとして、正しいものを、次のア~オの中からすべて選び、記号で答えなさい。
ア 25℃の水にほう酸をできるだけとかしたとき、その水溶液の酸性は市販の酢より強くなる。
イ クエン酸の水溶液は水でうすめると、その酸性の強さは弱くなる。
ウ クエン酸が水にとけた重さと、pHの7からの変化量の間には比例の関係かおる。
エ 市販の酢の中にスチールウールを入れると、あわが発生する。
オ 酸をとかした水溶液の濃度が同じであっても、ほう酸やクエン酸といった酸の種類が異なれば、水溶液の酸性の強さが同じになるとは限らない。
【解説と解答】
問1 A、Eは蒸発させて何も残らないので、気体か液体を溶質とする水溶液です。Aににおいがあることから、アンモニアか塩酸とわかるので、Eは炭酸水。炭酸水は二酸化炭素が溶けています。
(答え)炭酸水
問2 問1からAはアンモニア水か塩酸ですが、Aは青色リトマス紙を赤色にしたので、酸性ですから、塩酸。
(答え)塩酸
問3 残る固体が溶けた水溶液はB、C、Dで、重そう水、食塩水、石灰水になります。BとCがアルカリ性であることから、Dは食塩水とわかります。そうなると、重そう水か、石灰水を決める実験になるので、石灰水は二酸化炭素を吹き込めば白くにごります。
(答え)イ
問4 ほう酸は25℃の水80gに4.0g溶け、50℃の水にさらに4.8g溶けたので合計8.8g溶けました。80gの水に8.8gですから、100gの水には11.0g溶けます。
(答え)11.0g
問5 25℃、100gの水にホウ酸は4.0÷80×100=5.0gしか溶けません。したがって、7.0gを溶かすにも、7.0÷5.0×100=140gの水が必要になるので、必要な水は40gです。
(答え)40g
問6
ア 市販のお酢のpHは2~3程度。25℃の水に、できるだけほう酸を溶かしたとき、pHは5程度なので、お酢の方が酸性が強いことがわかります。
イ クエン酸を水80gに4.0g溶かしたらpHは2、60g溶かしたらpH1になっているので、水で薄めれば酸性は弱くなります。したがってこれは○。
ウ クエン酸が溶ける量には限界があるので、比例関係にはなりません。
エ スチールウールが反応するのはpH1程度なので、お酢では反応しません。
オ 濃度が同じでも、pHに違いが出るので、酸性の強さが同じになりません。これは○。
(答え)イ、オ
受験で子どもと普通に幸せになる方法、本日の記事
競争心がないと、がんばらないと思われているが・・・
フリーダムオンラインブログ 5年生の担任から
習い事やスポーツは、やめなければいけないものではない
【(株)邦学館からのお知らせ 】
WEBワークスを塾・個別指導でご利用いただける「フリーダムスポット」のご案内