2019年浅野中学の問題です。
次の文章を読んで、後の問いに答えなさい。
私たちは自然に存在する鉱石から様々な金属を取り出して利用しています。例えば、日本古来の「たたら製鉄」では、岳の中に砂鉄と【 A 】を交互に入れ、熱風を送り込んで鉄を取り出します。砂鉄は火成岩に含まれる磁鉄鉱などが、風化に伴って分離され、堆積したものです。
鉄は空気中の酸素と結びつきやすく、スチールウールをガスバーナーで加熱すると、燃えて【 B 】さびと呼ばれる酸化鉄が主にできます。この酸化鉄は磁鉄鉱の成分です。一方、スチールウールを湿った空気中に放置しておくと、鉄が徐々に酸素と結びついて【 C 】さびと呼ばれる別の酸化鉄ができます。人工的に鉄製品の表面を【 D 】さびで覆うと、内部の鉄がさびにくくなるので、調理器具や工具などで利用しています。
マグネシウムリボンをガスバーナーで加熱すると、白く明るい光を出しながら燃えて、【 E 】色の酸化マグネシウムに変わります。一方、鋼線をガスバーナーで加熱しても燃えませんが、表面が【 F 】色の酸化銅に変わります。
マグネシウムの粉末と鋼の粉末を使って、次の[実験1]~[実験5]を行いました。ただし、実験で用いた塩酸の濃度はすべて同じです。
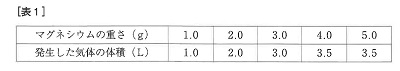
[実験1]マグネシウムの粉末に100mLの塩酸を加えました。マグネシウムの重さを変えて、1)発生した気体の体積をそれぞれ調べました。[表1]はその結果をまとめたものです。
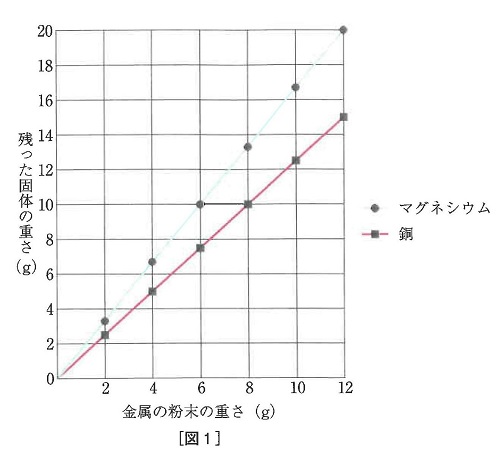
[実験2]マグネシウムの粉末をステンレス皿の上にうすく広げ、ガスバーナーで十分に加熱しました。マグネシウムの重さを変えて、加熱後に残った固体の重さをそれぞれ調べました。[図1]はその結果をまとめたものです。
[実験3][実験2]で加熱後に残った固体に塩酸を加えました。固体は溶けましたが、気体の発生は見られませんでした。
[実験4]銅の粉末について、[実験2]と同様の実験を行いました。[図1]はその結果をまとめたものです。
[実験5][実験4]で加熱後に残った固体に塩酸を加えました。固体は溶けましたが、気体の発生は見られませんでした。
(1)【 A 】にあてはまるものを、次のア~力の中から1つ選び、記号で答えなさ
い。
ア 石灰石 イ 消石灰 ウ ミョウバン エ 食塩 オ 木炭 力 重そう
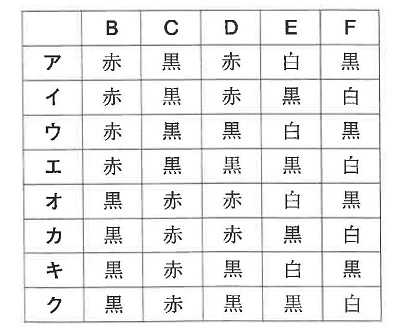
(2)【 B 】~【 F 】にあてはまる色の組み合わせを、次のア~クの中から1つ選び、記号で答えなさい。
(3)鉄にあてはまり、砂鉄にあてはまらないものを、次のア~オの中から2つ選び、記号で答えなさい。
ア 塩酸に溶けて、気体が発生する。
イ 水酸化ナトリウム水溶液に溶けて、気体が発生する。
ウ 電気を通さない。
エ 磁石に引きよせられる。
オ 使い捨てカイロに利用されている。
(4)マグネシウムにあてはまり、銅にあてはまらないものを、次のア~オの中から2つ選び、記号で答えなさい。
ア うすい硫酸水溶液に溶けて、気体が発生する。
イ 石灰水に溶けて、気体が発生する。
ウ 電気を通す。
エ 銀色の物質である。
オ 鍋やヤカンに利用されている。
(5)下線部①の気体にあてはまり、酸素にあてはまらないものを、次のア~オの中から2つ選び、記号で答えなさい。
ア 水に溶けにくい。
イ 空気より軽い。
ウ 無色である。
エ 刺激臭がする。
オ 燃料電池の燃料に利用されている。
(6)同じ重さの酸素と結びつく、マグネシウムと銅の重さの比を、もっとも簡単な整数比で求めなさい。
(7)銅の粉末6.4gをある程度加熱したところ、残った固体は6.8gでした。これに十分な量の塩酸を加えました。溶け残った固体は何gですか。
(8)マグネシウムの粉末6.4gをある程度加熱したところ、残った固体は7.6gでした。これに十分な量の塩酸を加えました。発生した気体は何Lですか。
(9)マグネシウムと鋼の混合粉末7.0gを十分に加熱したところ、残った固体は10.5gでした。混合粉末に含まれていた銅は何gですか。
(10)(9)と同じ混合粉末7.0gに含まれているマグネシウムを、すべて洛かすのに必要な塩酸は何mLですか。
【解説と解答】
(1)鉄を作るので木炭を交互に入れます。
(解答)オ
(2)焼いてできるのは黒さび。腐食するのが赤さび。スチールウールにできるのが白さび。焼いてできる酸化銅は黒さび。したがってキ。
(解答)キ
(3)砂鉄は塩酸には溶けません。またカイロに砂鉄を使うこともありません。
(解答)ア・オ
(4)銅は硫酸には溶けません。また色は銀色ではありません。
(解答)ア・エ
(5)水素です。酸素にあてはまらないものですから、イとオ。
(解答)イ・オ
(6)銅:酸化銅=4:5 したがって銅;酸素=4:1
マグネシウム:酸化マグネシウム=3;5 したがってマグネシウム:酸素=3:2
から酸素:銅;マグネシウム=2:8:3からマグネシウム:銅=3:8
(解答)3:8
(7)増えた酸素が0.4gですから銅;酸素=4:1から銅は1.6g反応していますので、まだ銅は6.4-1.6=4.8g残っています。これが溶け残ります。
(解答)4.8
(8)増えた酸素は1.2gです。反応したマグネシウムは1.2÷2×3=1.8gです。残ったマグネシウムは6.4-1.8=4.6gですから、表1より4.6L出ます。
(解答)4.6
(9)マグネシウムが【3】、銅が(4)入っていたとすると
【3】+(4)=7.0g 【5】+(5)=10.5gから【3】+(3)=6.3g
(1)=0.7gなので、0.7×4=2.8g
(解答)2.8
(10)100mLの塩酸で3.5gのマグネシウムから3.5Lの水素が発生します。
マグネシウムは7.0-2.8=4.2g入っていますから、100÷3.5×4.2=120mLになります。
(解答) 120
Newフリーダム進学教室からのお知らせ
受験で子どもと普通に幸せになる方法、本日の記事は
5年生の教室から
ペースの自由
算数オンライン塾
10月12日の問題
4年生の保護者のみなさまへ中学受験パパママ塾「ONE」のご案内