2021年海城中学の問題です。
以下の各問いに答えなさい。
I 炭酸水素ナトリウム,水酸化カルシウム,塩化ナトリウム,砂糖の4つの物質の性質や特徴について調べてみました。
問1 4つの物質の中の1つ、水酸化カルシウムを水に入れてよくかき混ぜました。この溶液を何といいますか。
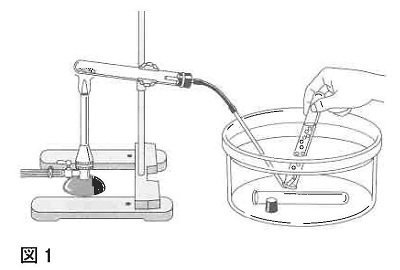
問2 4つの物質の中の1つを図1のような実験装置で5分間加熱すると、二酸化炭素が発生しました。この加熱した物質は何ですか。次のア~エから1つ選び、記号で答えなさい。
ア 炭酸水素ナトリウム イ 水酸化カルシウム ウ 塩化ナトリウム エ 砂糖
問3 4つの物質がそれぞれ入った容器があります。実験で容器のラベルがぬれてはがれてしまい、どの容器にどの物質が入っているか分からなくなってしまいました。それらの物質を特定するために、次のA~Dの実験を行いました。下の(1)~(3)に答えなさい。
A 試験管4本に、それぞれの固体を2gずつ入れ、少量のうすい塩酸を加えたときに、気体の発生があるかないかを調べた。
B 水の入った4つのビーカーに、それぞれの固体を入れてよくかき混ぜ、フェノールフタレインを加えた。
C 水の入った4つのビーカーに、それぞれの固体を入れてよくかき混ぜ、図2の実験装置で電流が流れるかどうかを調べた。
D lOOgの水の入った4つのビーカーに、固体をそれぞれ5gずつ入れてよくかき混ぜた。
(1)次の①,②の実験結果にあてはまる物質を、問2のア~エからそれぞれ1つずつ選び、記号で答えなさい。
①Bの実験で、うすく赤色になる。
②Dの実験で、ほとんど溶けないでにごる。
(2)A→B→C→Dの順番で実験を行うと、4つの物質はどの段階の実験ですべて特定できますか。A~Dの記号で答えなさい。
(3)A~Dの実験を全部行わなくても、4つの物質は特定できます。実験回数の一番少なくてすむ実験の組み合わせを例にしたがって答えなさい。例:EとGとH
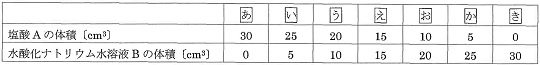
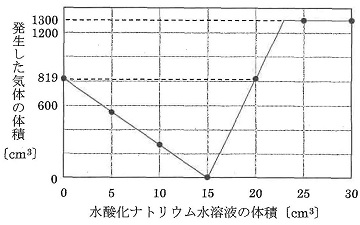
Ⅱ 物質Xの中に別の物質Yが不純物として入っている混合粉末が60gあります。この中から、純粋なXを取り出すために再結晶を行いました。この混合粉末のすべてを90℃の水に溶かしたらすべて溶けました。この溶液をゆっくり冷やしたところ、80℃でほんの少しXの結晶が出はじめました。さらに25℃まで冷やしたところ、Xの純粋な結晶が45g出ました。
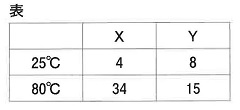
問4 表はX,Yが水100gにそれぞれの温度で最大何g溶けるのかを表しています。下の(1),(2)に答えなさい。必要であれば四捨五入して整数で答えなさい。
(1)混合粉末を溶かした水は何gですか。
(2)混合粉末中のXの割合は何%ですか。
【解説と解答】
問l 水酸化カルシウム水溶液のことを石灰水と言います。
(答え)石灰水
問2 過熱して二酸化炭素を出すのは炭酸水素ナトリウムです。
(答え)ア
問3
(1)フェノールフタレインで赤はアルカリ性ですが、問題ではうすく赤色となっているので、この場合は炭酸水素ナトリウムが該当します。水酸化カルシウムがこの中では一番水に溶けにくい性質を持っています。
(答え)(1) ① ア ② イ
(2)Aで炭酸水素ナトリウムがわかり、Bで石灰水がわかります。Cで砂糖水が通電しないので、ここで4つの性質がわかります。
(答え)C
(3)Bで炭酸水素ナトリウムと石灰水が特定できて、Cで砂糖水が特定できます。
(答え)BとC
問4
(1)水が【100】gあるとします。25℃で溶けているXを【4】とすると、80℃で溶けているXは【34】
その差の【30】が45gになるので、【1】=1.5から水は150g
(答え)150
(2)80℃で溶けているXは34×1.5=51gですから、51÷60×100=85%
(答え)85%
今後、投稿のタイミングを定時以外に増やしていきます。投稿のタイミングをTwitterでお知らせしていますので、ぜひフォローしてください。
田中貴のTwitter
合格手帳の9-11月号ができました。秋に向けてしっかり計画を立てていきましょう。
2021 合格手帳 5年生用9-11月号のお知らせ
受験で子どもと普通に幸せになる方法、本日の記事は
合格者を何人出せばいいか?
【塾でのご利用について】
フリーダム進学教室 WEB学習システムOEMのご案内