2019年豊島岡の問題です。
次の文章を読み,以下の問いに答えなさい。
ある濃さの塩酸(A液)とある濃さの水酸化ナトリウム水溶液(B液)をつくり,次の実験をしました。ただし,数値を答える場合は四捨五入して整数で答えなさい。
【実験1】
1gのアルミニウムにA液を加えていき,発生した気体の体積(mL)を調べました。その結果を表1にまとめました。

1gのアルミニウムにB液を加えていき,発生した気体の体積(mL)を調べました。その結果を表2にまとめました。

(1)実験1でアルミニウムと塩酸で発生した気体も,アルミニウムと水酸化ナトリウム水溶液で発生した気体も同じものでした。この気体の性質として最も適当なものを次のあ~えから1つ選び,記号で答えなさい。
あ・刺激臭があり,水に溶けるとアルカリ性になる。 .
い・燃えているロウソクをこの気体の中に入れると,ロウソクは激しく燃えて明るくなる。
う.石灰水を白くにごらせる。
え.すべての気体の中で,最も軽い。
(2)実験1をふまえて,0.8gのアルミニウムにA液60mLを加えたとき,発生する気体の体積は何mLか。
(3)1gのアルミニウムに110mLのA液を加えました。また,1gのアルミニウムに110mLのB液を加えました。反応が終わった後のそれぞれの溶液についての説明として,最も適当なものを次のあ~えから1つ選び,記号で答えなさい。
あ・反応後のA液,反応後のB液ともにアルミニウムが残る。
い・反応後のA液はアルミニウムが残るが,反応後のB液にはアルミニウムは残らない。
う・反応後のA液はアルミニウムが残らないが,反応後のB液にはアルミニウムは残る。
え・反応後のA液,反応後のB液ともにアルミニウムが残らない。
【実験2】
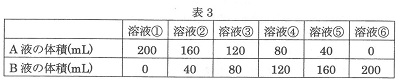
A液とB液をいろいろな割合で混合し,溶液①~⑥をつくりました(表3)。混合した後の溶液の体積はどれも200mLでした。
次に,溶液①~⑥のそれぞれに3gのアルミニウムを加えて発生する気体の体積を調べました。
200mLの溶液⑤に3gのアルミニウムを加えましたが,アルミニウムは溶けず,気体の発生も見られませんでした。
200mLの溶液②に3gのアルミニウムを加えたら アルミニウムの一部が溶け残りました。このとき,2100mLの気体が発生しました。
(4)アルミニウムと反応前の溶液②にBTB溶液を加えたときの色として最も適当なものを次のあ~おから1つ選び,記号で答えなさい。
あ.緑色 い.青色 う.黄色 え.赤色 お.紫色
(5)溶液⑤とアルミニウムが反応しなかったことと,下線部の結果から,「200mLの溶液②は150mLの溶液Aと同じはたらきをしている」と考えました。同様に考えると,200mLの溶液③は何mLの溶液Aと同じはたらきをしているといえますか。
(6)3gのアルミニウムに200mLの溶液④を加えたとき,発生する気体の体積は何mLか。
(7)200mLの溶液⑥に3gのアルミニウムを加えたところ,気体が発生しました。気体が発生し終わった後,残ったアルミニウムは1.5gでした。
溶液①~④のそれぞれに3gのアルミニウムを加え,気体が発生し終わった後の残ったアルミニウムを調べました。溶液⑥の結果と同じ1.5g残るものとして最も適当なものを次のあ~えから1つ選び,記号で答えなさい。
あ.溶液① い.溶液② う.溶液③ え.溶液④
【解説と解答】
(1)水素の性質ですから、え。
(解答)え
(2)A液100mLに対してアルミニウム1gで1400mLの水素が発生します。
A液60mLでアルミニウム0.8gですから1400×0.6=840mLでアルミニウムが0.2g溶け残ります。
(解答)840
(3)1400÷105=13.3333・・・よりB液133mLに対してアルミニウム1gで1400mLの水素が発生します。A液110mLに1gのアルミニウムを入れるとA液10mLが余り、水素は1400mL発生します。
B液110mLに1gのアルミニウムを入れると、アルミニウムが溶け残ります。
(解答)う
(4))溶液⑤で中和がおこっています。A:B=1:4ですから、②はA液が残るので酸性。
(解答)う
(5)下線部から、溶液②にはA液が150mL残り、1400×1.5=2100mLの水素が発生しました。このとき、3gのアルミニウムのうち1.5gが反応し、残り1.5gが溶け残っています。
溶液③は中和の割合からA液が20mL使われて、100mL残りますから、100mLと同じです。
(解答)100
(6)溶液④は中和の割合からA液30mLが使われて50mLが残りますから、0.5gのアルミニウムが反応し、1400×0.5=700mLの水素が発生します。
(解答)700
(7)1.5gが溶け残るためには、A液が150mLあって3gのうちの1.5gと反応しなければなりません。溶液②は中和の結果A液が10mL使われて150mL残りますから、いが正解です。
(解答)い
Newフリーダム進学教室からのお知らせ
受験で子どもと普通に幸せになる方法、本日の記事は
着手率と正解率
6年生の教室から
帰省先での授業
慶應進学館から
過去問をとっておかない
4年生の保護者のみなさまへ 中学受験パパママ塾「ONE」のご案内