2014年成城中学の問題です。
次の文を読み、以下の問いに答えなさい。
【実験1】
A~Dの4つのビーカーに、ある濃さの塩酸と、水酸化ナトリウム水溶液をそれぞれ加えて混ぜた後、BTB液を2、3滴加えました。加えた塩酸および水酸化ナトリウム水溶液の体積とBTB液を加えたときの色は次の表のようになりました。
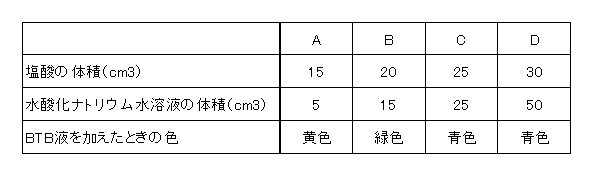 図1
図1
問1 この塩酸50㎝3をちょうど中和させるのに必要な水酸化ナトリウム水溶液は何cm3ですか。
問2 ビーカーAの水溶液をおだやかに熱して、出てきた気体を集めました。この気体の名前を答えなさい。
問3 次のア~オの金属のうち、ビーカーDの水溶液に加えて熱したところ、水素が発生するものをすべて選び、記号で答えなさい。
ア 鉄 イ 亜鉛 ウ 銅 エ 金 オ アルミニウム
【実験2】
実験1と同じ塩酸40㎝3に、実験1と同じ濃さの水酸化ナトリウム水溶液を加えてまぜた後、熱して水分を蒸発させ、残った固体の重さを調べました。水酸化ナトリウム水溶液の体積を変えて何回か実験したところ、次のグラフのような結果になりました。
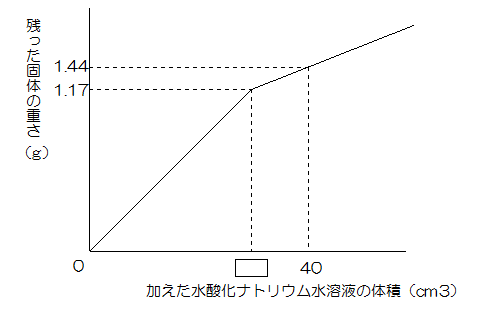
問4 グラフの中の空欄にあてはまる数を答えなさい。
問5 塩酸40㎝3に、水酸化ナトリウム水溶液50㎝3を加えて熱したとき、残った個体には2種類の物質が含まれていました。何という物質が何g含まれていましたか。
【解説と解答】
問1
BのBTB反応が緑色になっているので塩酸:水酸化ナトリウム水溶液=4:3で中和します。
したがって50×$$\frac{3}{4}$$=37.5
【答え】37.5cm3
問2
Aは酸性のままですから、塩酸が残っています。したがって熱すれば塩化水素が出てきます。
【答え】塩化水素
問3
Dは水酸化ナトリウム水溶液が残っています。したがって水素が発生するのは亜鉛とアルミニウムです。
【答え】イとオ
問4
中和は4:3とわかっていますから塩酸40㎝3を中和させる水酸化ナトリウム水溶液は30cm3です。
【答え】30cm3
問5
グラフから水酸化ナトリウム10cm3には水酸化ナトリウムが1.44-1.17=0.27g含まれています。
グラフから中和でできる食塩は1.17gとわかっていますから、残り水酸化ナトリウム20㎝3に含まれる水酸化ナトリウムは0.27×2=0.54gです。
【答え】
食塩1.17g 水酸化ナトリウム0.54g
=============================================================
中学受験で子どもと普通に幸せになる方法、本日の記事は
土曜授業復活?
==============================================================
今日の慶應義塾進学情報
志望理由を100字以内で書く
==============================================================

==============================================================

==============================================================
![]()
にほんブログ村


