2015年浦和明の星中学の問題です。
アルミニウム、石灰石、鉄の3種類の物質に、それぞれうすい塩酸または水酸化ナトリウム水溶液を加えたところ、気体を発生してとけました。このときの、とかした物質の重さと発生した気体の体積の関係について調べました。
(実験1)アルミニウム3gにうすい塩酸を加えて全部とかしました。このとき、気体Aが3.6L発生しました。
(実験2)アルミニウム3gに水酸化ナトリウム水溶液を加えて全部とかしました。このとき、気体Bが3.6L発生しました。
(実験3)石灰石25gにうすい塩酸を加えて全部とかしました。このとき、気体Cが5.6L発生しました。
(実験4)鉄7gにうすい塩酸を加えて全部とかしました。このとき、気体Dが2.8L発生しました。
問1 気体A~Dの中で1つだけ異なる気体があります。その異なる気体はどれですか。A~Dで答えなさい。また、その異なる気体の名称を答えなさい。
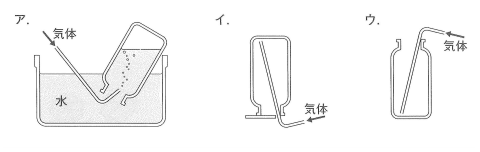
問2 実験1で発生した気体Aを集めるのに、もっとも適当な方法を下の図から選び、ア~ウで答えなさい。
問3 実験1で発生した気体Cについてあてはまることがらを選び、ア~ウで答えなさい。
ア 空気にふくまれる気体の中で、もっとも量が多い。
イ 水を加熱したときに発生する気体である。
ウ この気体と水をペットボトルに入れ、ふたを閉じてよくふるとペットボトルがへこむ現象がみられる。
エ 植物が日光に当たったときにつくる気体である。
オ 無色で、つんとした刺激のあるにおいがする気体である。
問4 アルミニウム10gと鉄10gに、それぞれうすい塩酸を加えて全部とかしました。そのとき発生する気体の体積は、アルミニウムと鉄のどちらの方が大きくなりますか。また、その差は何Lですか。
問5 重さの合計が110gになる石灰石と鉄があります。それぞれにうすい塩酸を加えて全部とかしました。このときに発生した気体の体積の合計は30.8Lでした。はじめにあった鉄の重さは何gですか。
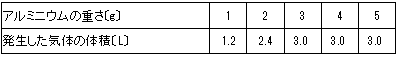
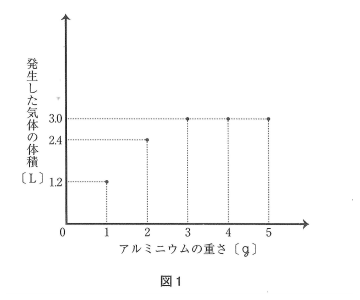
問6 うすい塩酸50mLを入れた容器を5つ準備しました。それにアルミニウムを1g、2g、3g、4g、5gと重さを変えて加え、発生した気体の体積をそれぞれはかりました。アルミニウムの重さと発生した気体の体積は蒙のような結果になりました。また、この表の値をグラフに点で示したところ図1のようになりました。このうすい塩酸100mLにアルミニウム20gを加えた場合、とけないで残っているアルミニウムは何gですか。
【解説と解答】
問1
石灰石に塩酸をかけると、二酸化炭素が発生します。それ以外は全部水素が発生しています。
(答え)C 二酸化炭素
問2
気体Aは水素ですから、水上置換で集めます。
(答え)ア
問3
気体Cは二酸化炭素ですから、ウ。水に溶けるので、外気圧が強くなります。
(答え)ウ
問4
実験4で鉄を3gにすると、発生する水素は2.8÷7×3=1.2Lなので、アルミニウムの方が発生し、その差は
3.6-1.2=2.4Lです。問題は10gで聞いているので2.4÷3×10=8Lです。
(答え)アルミニウム 8L
問5
全部石灰石であれば110÷25×5.6=24.64L
差は30.8-24.64=6.16L 鉄は1gについて0.4Lで、石灰石は5.6÷25=0.224Lですから、
6.16÷(0.4-0.224)=6.16÷0.176=35が鉄の重さになります。
(答え)35g
問6
表から1gあたり1.2L増えるはずですが、3gのところで3.0Lになっているので、3.0÷1.2=2.5gしか溶けないことがわかります。
100mLの場合、その2倍で5gしか溶けないので、溶け残るアルミニウムは20-5=15gです。
(答え)15g
==========================================================
中学受験で子どもと普通に幸せになる方法、本日の記事は
長い入試
==============================================================
中学受験 算数オンライン塾
1月24日の問題
==============================================================

==============================================================
==============================================================

==============================================================
![]()
にほんブログ村