2024年桜蔭中学の問題です。
つぎの文章を読み、下の問いに答えなさい。
水溶液を冷やしたり、水分を蒸発させたりすると、とけているもの(固体)はつぶとなって出てきます。これを結晶といい、ものによって結晶の形や色は決まっています。
たとえば、湯に砂糖をできるだけ多くとかしてから、ゆっくり冷やしていくと(1)結晶が出てきます。これと同じやり方で食塩の結晶は出てくるでしょうか。残念ながら、ほとんど出てきません。なぜなら、食塩は( 2 )からです。食塩の結晶を取り出すには、食塩水から水を蒸発させなければいけません。食塩は100℃での水100gに39.3gまでとけます。
100℃での食塩水から水を蒸発させる場合、食塩の結晶ができ始めるとき、まだ食塩水の( 3 )%が水分ですから、これをすべて蒸発させるのは大変です。食塩水から食塩を取り出すには大きなエネルギーが必要なのです。
海水には約3%の塩(食塩)がとけていますが、海水をそのまま煮つめて塩を取り出すのでは能率が良くないので、こい塩水をつくる工夫が欠かせません。
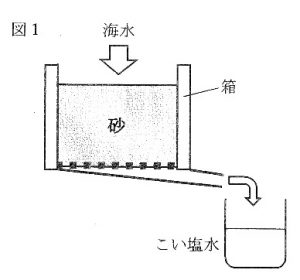
日本で古くから行われてきた塩づくりに揚浜(あげはま)式製塩という方法があります。まず、細かい砂がしきつめられた塩田の上に海水をていねいにまきます。海水が地下にしみこまないように、塩田の下は( 4 )の層になっています。太陽のエネルギーにより水分が蒸発し、かわいた砂の表面には塩の結晶がつきます。塩のついた砂を集めて、塩田に設置してある箱の中に入れます。(5)箱の上から海水を流しこむと、砂の表面についた塩が海水にとけこみ、こい塩水が下からでてきます。図1は箱の断面を表しています。この塩水を、大きな(6)かまに入れて煮つめていきます。はじめは強火で煮つめ、水分がある程度蒸発したところでいったん火を消して(7)冷まします。その後、弱火でさらに煮つめ、かまの底にたまった塩を取り出します。このように、海水からの塩づくりでは、さまざまな工夫がなされているのです。
問1 下線部(1)はどのような形ですか。もっともふさわしいものをつぎのア~オから1つ選び、 記号で答えなさい。

問2 文中の( 2 )にあてはまる語句を25字以内で書きなさい。
問3 文中の( 3 )にあてはまる数字を、小数第2位を四捨五入して、小数第1位まで求めなさい。
問4 文中の( 4 )にあてはまる語をつぎのア~オから1つ選び、記号で答えなさい。
ア.れき イ.砂 ウ.粘土 エ.軽石 オ.木
問5 下線部(5)について述べたつぎの文の(a)~(e)にあてはまる数字を答えなさい。ただし、 答えが割り切れない場合は、小数第2位を四捨五入して、小数第1位まで求めなさい。
海水を3%の食塩水とし、箱の下から出てくる「こい塩水」を12.7%の食塩水とします。
100kgの「こい塩水」をつくる場合を考えてみましょう。箱の上から入れた海水はすべて下から出てくるものとし、蠢中で水は蒸発しないものとします。100kgの「こい塩水」にふくまれる水は(a)kgなので、箱の上から流しこむ海水は(b)kg です。箱の上から流しこむ海水にとけている塩は(c)kgですから、砂の表面から海水にとけこむ塩の量は(d)kgと計算できます。それだけの塩がついた砂をつくるためには、少なくとも(e)kgの海水を塩田にまく必要があります。
問6 下線部(6)のかまは、平らなおけのような形をしていて、内側は右図のような直径1.6m、高さ30 cm の円柱形だとすると、かまいっぱいに入る塩水はおよそ何Lですか。もっとも近いものをつぎのア~力から1つ選び、記号で答えなさい。
ア.200 イ.600 ウ.2000 エ.6000 オ.20000 カ.60000
問7 下線部(7)のとき、しばらくすると液面にいくつかの塩の結晶が見られることがあります。その理由として正しいものを、つぎのア~エから1つ選び、記号で答えなさい。
ア.底よりも液面に近いほうがうすい塩水なので、液面に結晶がうかぶ。
イ.液面は蒸発が盛んなので、液面の近くで結晶ができる。
ウ.底の近くから温度が下がるので、液面の近くで結晶ができる。
エ.1cm3 あたりの重さは、塩水よりも結晶のほうが小さいので、液面に結晶がうかぶ。
【解説と解答】
問1 砂糖の結晶は、エのような形が上下についています。
(答え)エ
問2 食塩は水の温度が変わっても、溶ける量があまり変化しません。
(答え)水の温度が変化しても、溶ける量はほとんど変わらない。
問3 100÷(100+39.3)×100=71.78・・・≒71.8
(答え)71.8
問4 海水が地下にしみ込まないようにするので、粘土の層にします。
(答え)ウ
問5
a=100-12.7=87.3
b=87.3÷(100−3)×100=90
c=90×0.03=2.7
d=12.7ー2.7=10
e=10÷0.03≒333.3
(答え) a 87.3 b 90 c 2.7 d 10 e 333.3
問6 80×80×3.14×30÷1000=602.88≒600L
(答え)イ
問7 液面で、蒸発が盛んなので、液面の近くでも結晶ができやすくなります。
(答え)イ
中学受験で子どもと普通に幸せになる方法、本日の記事は
解説がわからない
中学受験を2年間でオンライン塾と模試だけで合格させるパパママ塾「田中貴社中」
笑顔を取り戻そう
中学受験 算数オンライン塾
5月12日の問題
【塾でのご利用について】
塾でWEBワークスをご利用いただける「フリーダムスポット」のご案内