2024年 浅野中学の問題です。
次の文章を読んで、後の問いに答えなさい。
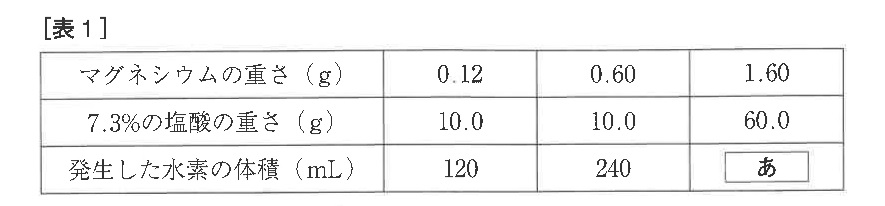
マグネシウムは銀白色の金属です。マグネシウムに塩酸を加えると、水素を発生し、塩化マグネシウムの水溶液に変化します。マグネシウムに7.3%の塩酸を加えたとき、発生した水素の体積を調べたところ、[表1]のようになりました。
このようにマグネシウムと塩酸を反応させたとき、水溶液は塩化マグネシウムの水溶液になります。水分を蒸発させると、塩化マグネシウムの白い固体を取り出すことができます。
また、金属のマグネシウムの薄い板は、マッチなどでたやすく火をつけることができ、明るい白い光を放って燃え、酸化マグネシウムと呼ばれる白い粉になります。この酸化マグネシウムに塩酸を加えると反応し、塩化マグネシウムの水溶液に変化しますが、気体は発生しません。
(1)金属のマグネシウム、酸化マグネシウム、塩化マグネシウムは身の回りのさまざまな場面で使われています。次の①~③の場面で使われているものはどれですか。
もっとも適切な組み合わせを、後のア~力の中から1つ選び、記号で答えなさい。
① 海水に含まれ「にがり」とも呼ばれる。豆乳から豆腐を作るときに使う。
② 銅とともにアルミニウムに混ぜて軽い合金にし、飛行機などの材料に使う。
③ 塩酸とおだやかに反応する性質を用い、胃腸薬の一種として用いる。

(2)7.3%の塩酸25.0gと過不足なく反応するマグネシウムは、何gになりますか。次のア~コの中から1つ選び、記号で答えなさい。
ア 0.03g イ 0.06g ウ 0.12g エ 0.30g オ 0.60g
カ 1.20g キ 3.00g ク 6.00g ケ 12.00g コ 30.00g
(3)[表1]のあにあてはまる数値を整数で答えなさい。
-
(4)マグネシウム1.20gに十分な量の塩酸を加え、マグネシウムがなくなるまで反応 させたとき、残った水溶液の水分を蒸発させてできた塩化マグネシウムの固体は 4.75gでした。[表1]の実験にある「マグネシウム1.60gに7.3%の塩酸60.0gを 加えて反応させた」水溶液から水分を蒸発させてできた固体の重さは何gですか。
もっとも近いものを、次のア~コの中から1つ選び、記号で答えなさい。ただし、マグネシウムが全て反応せずに一部が残っている場合には、できた塩化マグネシウムと反応しなかったマグネシウムの両方が固体に含まれるものとします。
ア 1.4g イ 1.5g ウ 2.8g エ 2.9g オ 4.7g
カ 4.9g キ 5.7g ク 5.9g ケ 6.3g コ 7.3g
(5)マグネシウム6.0gを完全に燃やしたときにできる酸化マグネシウムは10.0gとなります。いま、マグネシウム12.0gを燃やしたところ、燃え残りがあり、できた酸化マグネシウムと燃え残りのマグネシウムが混ざった固体の重さは15.2gでした。
(a)固体の中のマグネシウムの燃え残りは何gですか。
(b)この固体に塩酸を加え、残りのマグネシウムが全て反応してなくなるまでに発生する水素は何mLですか。
【解説と解答】
(1)金属のマグネシウムは、②になるのはわかるかと思います。問題は酸化マグネシウムと塩化マグネシウム。なんとなく「にがり」は塩化マグネシウムかな?と思う受験生は多かったのではないでしょうか。海に関係している感じがしますからね。塩化マグネシウムは海水からとります。そしてこれがにがりの原料になります。酸化マグネシウムは、塩酸の作用を抑える働きがあることから、胃酸過多などの症状を和らげる胃腸薬として使われます。
(答え)オ
(2)7.3%の塩酸10gに対して、マグネシウム0.12gと0.60gだと5倍になっていますが、気体の発生は2倍にとどまっています。したがって、7.3%の塩酸10gとマグネシウム0.24gが過不足なく反応して、水素を240mL発生させることがわかるので、25g÷10g=2.5倍ですから、0.24×2.5=0.6gになります。
(答え)オ
(3)塩酸が60gあるので(2)から反応するマグネシウムは0.24×6=1.44gですから、マグネシウムの方が多いので、塩酸によって発生する水素の量が決まります。
塩酸が6倍ですから240×6=1440mL
(答え)1440mL
(4)マグネシウム1.2gが充分に塩酸に反応すると、4.75gの塩化マグネシウムができます。(3)から反応するマグネシウムは1.44gですから、1.44÷1.2=1.2倍ですから、4.75×1.2=5.7gになります。ただし、塩酸が切れているので、1.6-1.44=0.16gのマグネシウムが反応せずに残っています。したがって、5.7+0.16=5.86gからク。
(答え)ク
(5)
(a) 反応したマグネシウムを【3】g、反応しなかったマグネシウムを12-【3】gとすると、反応すると酸化マグネシウムは6gから10gになるので、【3】のマグネシウムは【5】になります。
したがって【5】+12ー【3】=15.2gから【2】=3.2g 【1】=1.6g 12-1.6×3=7.2g
(答え)7.2g
(b)酸化マグネシウムは塩酸に反応しても水素は発生しません。したがって残りのマグネシウム7.2gを反応させたときの水素の発生量です。
0.24gのマグネシウムが240mLの水素を発生しますから、7.2÷0.24×240=7200
(答え)7200mL
中学受験で子どもと普通に幸せになる方法、本日の記事は
組み分けを受けなければ、子どもの見方が変わるかも
中学受験を2年間でオンライン塾と模試だけで合格させるパパママ塾「田中貴社中」
学習管理のポイント
中学受験 算数オンライン塾
4月22日の問題
【塾でのご利用について】
塾でWEBワークスをご利用いただける「フリーダムスポット」のご案内







